TISSUE ENGINEERING: la nuova frontiera

Chi non ha mai sentito parlare
di trapianto d'organi o visto una scena in una qualunque serie televisiva dove
i medici trasportano in elicottero organi appena espiantati e con un tempo di
vita ristretto destinati a pazienti bisognosi? E chi non ha mai sentito parlare
di rigetto indotto da corpo estraneo proveniente da donatore?
Tutto ciò, forse, un indomani, potrebbe essere solo un ricordo citato in
bibliografia!
Come ben noto il nostro organismo è una splendida organizzazione che vive in
omeostasi, ovvero, detto molto banalmente, cerca di autoregolarsi. Per tale
motivo non appena in esso viene introdotto un qualcosa che normalmente non era
presente, ed altera l'equilibrio preesistente, attiva un efficiente e selettivo
meccanismo di difesa atto a debellarlo. Nel caso specifico di un trapianto
d'organo, i protagonisti del sistema immunitario, riconoscono i determinanti
antigenici presenti sulla superficie dell'organo proveniente da un donatore e
lo attaccano, dando vita al fenomeno di rigetto. Per ovviare a tale fenomeno si
possono intraprendere molteplici strade, tra cui la più utilizzata prevede la
somministrazione al ricevente, in fase pre e post operatoria, di opportuni
farmaci che però hanno la possibilità di rendere il paziente immunodeficiente e
dunque maggiormente soggetto ad attaccato da agenti patogeni. Ciò avviene normalmente anche quando
l'organismo entra in contatto con un corpo estraneo di origine non biologica,
come una protesi, una valvola cardiaca etc., e a causa della sua natura cerca di
isolarlo avvolgendolo da una capsula fibrotica che può andare a recare danni ai
tessuti circostanti. In essa possono addirittura colonizzare popolazioni
batteriche che, non essendo raggiungibili dalle sostanze antibiotiche a causa
della impermeabilità della struttura della capsula, in caso di rottura, possono
riversarsi nell'organismo e raggiungere altri bersagli.
Ma se tutto ciò potrebbe essere evitato? Se il ricevente diventasse lui stesso
donatore?
Questi sono gli interrogativi principali al quale la medicina e l'ingegneria
tissutale, e più in generale l'ingegneria biomedica, stanno cercando di dare
una risposta.
A tal proposito la strada che si sta intraprendendo e della quale si sta
sperimentando l'efficacia è quella che va sotto il nome di "Ciclo dell'ingegneria
tissutale".
Esso vede come primo step il prelevamento di cellule specializzate del paziente
(atologhe) provenienti dall'organo-regione da sostituire o riparare. Come
alternativa si possono utilizzare le cellule staminali (non embrionali poiché
in Italia la legge lo vieta, ma dal midollo spinale del paziente adulto) non
specializzate, ma multipotenti, ovvero in grado di suddividersi in determinate
classi cellulari. Queste però sono ad oggi meno utilizzato in ambito
sperimentale, ma sono ancora oggetto di numerosi studi in vitro, poiché è molto
difficile garantire loro un microambiente ideale per farle specializzare in
cellule desiderate e non in altre non volute.
Le cellule prelevate vengono successivamente isolate e disposte su specifici
supporti di crescita (ad esempio piastre di Petri arricchite di nutrienti e di
fattori di crescita), poi introdotti in incubatrici, sotto atmosfera protetta e
controllata, per incrementare il loro numero. Una volta ottenuta una quantità
sufficiente, le cellule vengono adagiate su uno scaffold (letteralmente
impalcatura) della forma e dimensione congrue allo scopo medico, che favorisce
loro sostegno promuovendone l'adesione e la proliferazione. Allo scopo di
facilitare questi meccanismi, viene inserito il tutto in appositi costrutti,
detti bioreattori, che emulano le condizioni dell'ambiente biologico nel quale
deve essere inserito. Al termine di questo processo, si può procedere
all'impianto nel paziente.
Particolare importanza in questa strada va data dunque allo scaffold, che è la
struttura portante del costrutto, e che, una volta impiantato, dovrà interagire
con l'ambiente biologico e integrarsi perfettamente senza dare reazioni
avverse. A tal proposito essi devono possedere alcune
caratteristiche importanti affinché possano essere definiti tali.
Devono essere:
biocompatibili
biodegradabili
facilmente fabbricabili
e non devono indurre risposte avverse.
Per la loro costruzione sono diversi i materiali candidati anche loro con diverse caratteristiche che li contraddistinguono quali, biocompatibilità, proprietà meccaniche, fornire una matrice temporanea, essere biomimetici e consentire la diffusione di nutrienti per la crescita cellulare.
In base al tipo di materiale usato si distinguono scaffold:
SINTETICI: ovvero si ricorre all'uso di polimeri sintetici PLA, PCL, PGA rispettivamente acido polylattico, polycaprolattone e acido polyglicolico il cui vantaggio sta nel fatto che riescono a variare le loro proprietà sia meccaniche che di biocompatibilità agendo sulla composizione chimica incrementando adesione e proliferazione cellulare. Però presentano lo svantaggio di trombogenesi da parte dei polimeri.
BIOLOGICI: si ricorre all'uso di componenti dell'ECM (matrice extra-cellulare) come collagene, Hyaff (acido ialuronico modificato mediante esterificazione) e fibrina. Tra le matrici più promettenti vi è il pericardio umano riconosciuto come self dal sistema immunitario. Lo svantaggio in questo caso sta nel fatto che questi materiali non sono disponibili in grandi quantità ed inoltre processi di decellularizzazione possono alterare la stabilità della matrice e far perdere di eccellenza alle proprietà meccaniche.
In linea di principio possiamo dire che scaffold biologici sono sicuramente biocompatibili, ma difficilmente processabili e riproducibili, mentre scaffold sintetici sono più facilmente processabili, ma non sono nati con quello scopo per cui la scelta non è scontata.
L'applicazione di scaffold maggiormente diffusa e quella per le valvole cardiache.
Al giorno d'oggi vi sono vari tipi di valvole cardiache:
VALVOLE MECCANICHE: queste sono durevoli, ma potenzialmente trombogeniche (formazione di trombi, ovvero agglomerati piastrinici), quindi il paziente che riceve la valvola cardiaca meccanica riceve anche una terapia anticoagulante a vita proprio per evitare la forma di trombi.
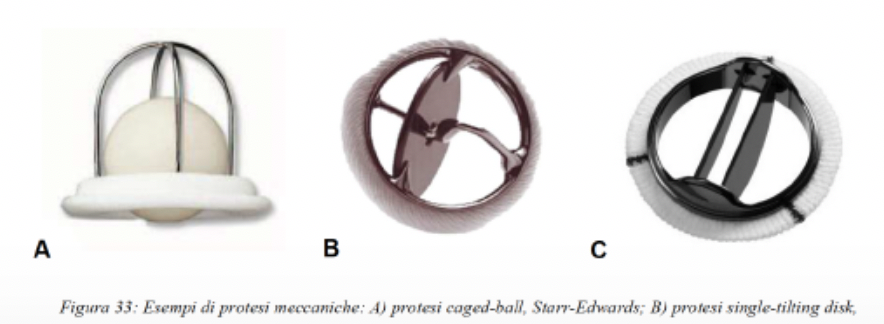
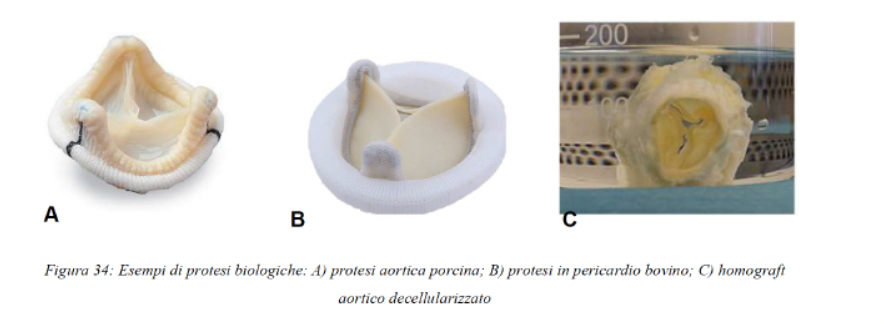
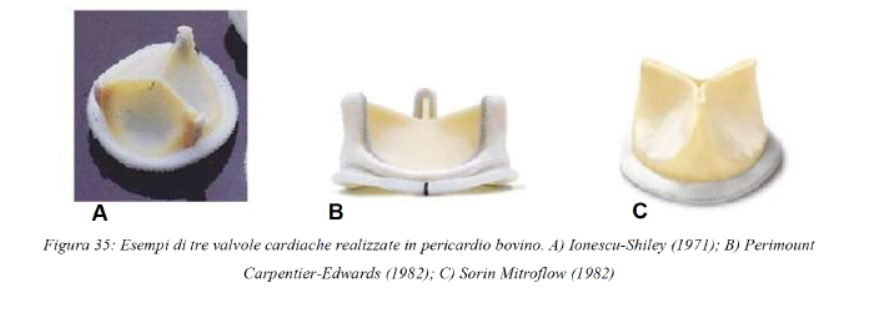
VALVOLE BIOLOGICHE: sono invece ottenute da
pezzettini di pericardio, non sono trombogeniche e questo è un grosso vantaggio
ma allo stesso tempo sono meno durevoli rispetto alle meccaniche. La loro
durabilità è dovuta al fatto che per coprire i determinanti antigenici per
evitare reazioni di rigetto vengono applicati dei severi trattamenti come ad
esempio usando la gluteraldeide che è citotossica e causa di calcificazione.
VALVOLE TRANSCUTANEE: applicabili invece senza chirurgia a cielo aperto ma soltanto attraverso un catetere. Queste si distinguono in stent self-expandeble cioè lo stent si apre da solo, oppure stent baloon-expandeble ovvero lo stent si espande attraverso un palloncino. Il vantaggio di queste ultime è garantito dalla minor invasità.

A questo proposito l'idea adottata in medicina è quella di applicare valvole meccaniche su pazienti giovani, mentre quelle biologiche su pazienti anziani. Equiparare l'aspettativa di vita alla durabilità delle valvole.
Il futuro però sta nelle VALVOLE CARDIACHE INGEGNERIZZATE ottenute mediante tecniche di tissue engineering, come gli scaffold di cui abbiamo parlato sopra.
Se vogliamo descrivere il processo di produzione per lo scaffold di una valvola cardiaca, prendiamo come esempio un paziente valvulopatico, ovvero in cui le sue valvole non funzionano in quanto aprono/chiudono male per cui devono essere sostituite chirurgicamente. Lo scopo dell'ingegneria tessutale è produrre qualcosa di biologico e totalmente vivente capace di integrarsi nel tessuto del paziente.
Si prelevano delle cellule autologhe dal paziente, che diventa così donatore di se stesso, le cellule vengono poi separate dal tessuto ed espanse in vitro fino ad averne una quantità sufficiente, per poi seminarle su uno scaffold che riproduce la morfologia della valvola, una volta aderite allo scaffold il costrutto viene inserito in un bioreattore che in condizioni di pressioni e flusso adeguate lo fa maturare per poter poi essere innestato nel paziente. Questo risulta molto utile nei pazienti pediatrici poiché l'organo cresce insieme al bambino, cosa che invece non avviene con quelle meccaniche che devono essere sostituite con scadenza periodica.
Maria Giovanna Serra
Nicolas Colombarini